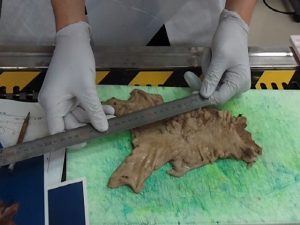
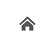切り出しの際にカセットに収まる大きさに切るのがポイントですが、カセット内に切り出した組織を隙間無く詰めると、パラフィン等の溶剤の入りが悪くなり、薄切が困難になり、染色性も悪くなります。<大まかな流れ>
・検体受付
・新鮮臓器写真撮影
・固定(通常はホルマリン)
・切り出し
・標本作製
・カセット詰め
・脱水・脱脂・パラフィン浸透
・包埋・ブロック作製
・薄切
・切片のスライドグラス貼付
・伸展
・乾燥
・脱パラフィン
・染色
・脱水
・透徹
・封入
・標本観察・診断
・結果報告・標本保管
受付
 検体と依頼伝票の確認
検体と依頼伝票の確認
依頼伝票に患者情報など必要事項が記載されているか、提出された検体が依頼伝票の内容と一致するか確認をします。
確認する内容は、氏名や性別、年齢などの患者プロフィール、検体が何か、個数などは特に大事です。検体の取り違えは医療事故につながるので、少しでもおかしい所があれば、すぐに担当医に確認をしましょう。
バーコード等の IT 機器の利用が推奨されます。
固定
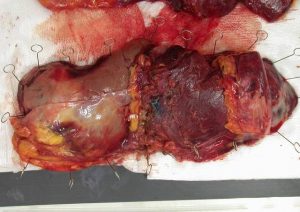
ゴム板(ホルマリンボード)や発泡スチロールなどの板に虫ピンなどで臓器を貼りつけて、ホルマリンに漬けて固定します。
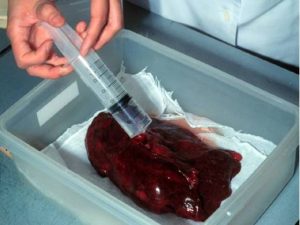
固定液 (通常は、10-20%緩衝ホルマリンを用います)
ホルマリン注入の際にはホルマリンガス対策が必要です。
・固定不良に注意!
・ホルマリン固定液濃度、固定液量、固定時間、固定する臓器のサイズが重要です。
・固定は速やかに行いましょう。
・固定液の量に注意。組織とホルマリンの比は、1:20くらいを目安にします。
・乾燥や未固定組織への水道水での水洗は、不良標本の原因となります。
・大きい検体は、切り出し時に適切な大きさにカットします。固定不良の場合、組織の自己融解がおこったり、腐敗したりします。
・過固定(長時間固定)も染色性が悪くなります。
臓器写真撮影
 臓器の写真撮影
臓器の写真撮影
全体像(表と裏)、病変部のアップや割面などをとります。
今はデジタルカメラが主流ですので、多少撮影枚数が増えても構いません。
切り出し後は検体がバラバラとなるため、写真による記録は大事です。
生検体を扱う場合は感染等に注意しましょう。固定後の臓器撮影の場合にはホルマリンガス対策が必要です。
切り出し
提出された組織が大きなものは、全体を標本作製をすることが困難な場合があります。その場合、必要な部分を切り出して標本を作製します。切り出す部位は、主病変を中心に行いますが、比較対照の為の正常部分を切り出したり、腫瘍性病変の場合は腫瘍と正常部位の境界(断端)部分も採取し、全ての病変部分を取り切っているか評価します。
切り出しの際には肉眼観察が重要です。不明な点があったら、担当の臨床医に速やかに連絡し確認しましょう。
病変の性状を観察し、大きさを測定して、記載します。
切り出しの前に、ホルマリンに浸けられた検体を十分に水洗いしてホルマリンを洗い流します。
正しい診断は正しい切り出しから・・・。切り出しマニュアルを整備しましょう。
適切な部位から適切な個数を切り出します。
悪性腫瘍の場合は、臓器ごとの取扱い規約に沿った診断が必要ですので、それに応じた切り出しをします。
ナイフによるケガに注意しましょう。
カセット詰め

切り出しした標本は、標本作製のための専用プラスチック製カセットに入れます。

切り出しの際にカセットに収まる大きさに切るのがポイントですが、カセット内に切り出した組織を隙間無く詰めると、パラフィン等の溶剤の入りが悪くなり、薄切が困難になり、染色性も悪くなります。

胃生検組織など小さな検体は、ピンセットでカセットに入れます。
脱水・脱脂・パラフィン浸透
パラフィン浸透装置
・組織検体にパラフィンを浸透させるため、検体に含まれる水をアルコールに、次にキシレン(施設によりクロロホルムを使用)に、そして最後にパラフィンへ自動的に置き換える装置です。この工程は約一晩かかります。
包埋・ブロック作製

包埋皿に切り出した組織をセットし、そこに溶解しているパラフィン(約60℃)を流し込み、冷却しパラフィンブロックを作製します。
薄切

ミクロトームと呼ばれる道具で薄切し切片を作製します。
切片の厚さは、 通常3~4 μm (3/1000~4/1000 mm) 程度ですが目的により様々です。

薄切された切片を、湯冷ましの水に浮かべます。
水(またはぬるま湯)に浮かべた切片を、スライドガラスにのせて貼りつけます。
薄切時にはミクロトームの刃などによるケガに注意しましょう。
伸展

水に浮かべた切片をスライドガラスにすくい取り、伸展器の上で切片を元の面積にまで膨張させ、ガラスに貼付けます。また、微温湯に切片を浮かべ伸展する方法も有ります。
乾燥

切片を貼付けたスライドガラスを約60℃の乾燥機の中で乾燥させます。これによりパラフィンが溶解し、スライドガラスから切片が剥がれにくくなります。
染色
染色の工程
(1)脱パラフィン
検体がパラフィン浸透したままでは染色されないため、パラフィンを溶かし洗い出す必要があります。これを脱パラフィンといいます。
脱パラフィンにはキシレンを用い、その次にアルコール、水に浸けます。
(2)HE染色
病理組織検査の基本的な染色方法は、ヘマトキシリン・エオシン (Hematoxylin-Eosin) 重染色(以下H-E染色)といい、ヘマトキシリン染色液とエオシン染色液による二重染色を行います。
ヘマトキシリンは青紫色の色素です。細胞核を暗青色に染色します。軟骨組織や粘液の一部も淡く染色されます。
エオシンは赤紫色の色素です。細胞質や赤血球、膠原線維などが染色されます。
封入
自動封入装置
封入剤
カバーガラス
染色後は、さらにアルコールによる脱水、キシレンによる透徹を行います。
封入剤をつけてカバーガラスで覆います。
染色後は、さらにアルコールによる脱水、キシレンによる透徹を行い、最後に封入しHE標本の完成です。
封入とは、スライドガラス上の染色された組織切片全体を、粘着性のある有機溶剤を糊として用いて、カバーガラス(厚さ 0.1?0.15mm)で密封する作業です。これにより光学顕微鏡下で標本を観察する事が可能となります。
これでHE染色組織標本の完成です。
※病理組織標本の作製工程には、病理医の標本への嗜好や病理担当技師の経験、個々の施設の伝統により培われた多種多様の機器、道具が工夫され使用されています。また、染色法も試薬のメーカーや使用試薬の種類、染色時間が工夫されており様々です。これらを標準化する事も大切ですが、個々の技術をより広く学習/修得する事が必要です。
標本観察・診断

病理医は光学顕微鏡で標本を観察し、病理診断を下します。
病理医は、必要であれば別の染色をオーダーし、臨床検査技師は再びパラフィンブロックから切片を薄切し、別の染色に取りかかります。
結果報告・標本保管

結果は病理診断報告書として印刷され、患者の担当医師の元へ送られますが、最近では電子化によりオンライン上で結果報告をすることが増えています。
病理診断が行われた標本は標本棚に収納されて保管されます。